Het getal van Avogadro, ofwel: hoe klein zijn atomen en moleculen?

Het getal van Avogadro, ofwel: hoe klein zijn atomen en moleculen?
Laatste update: 17-01-2023
Waarom is de lucht blauw? Hoeveel vingerhoedjes water zitten er in de oceaan? En hoe groot is de kans dat je met dertig dobbelstenen alleen maar zessen gooit? Al die vragen kun je beantwoorden met het getal van Avogadro. Dat getal vertelt je hoeveel atomen ergens in zitten.
Redacteur: Arnout Jaspers
Het idee dat alles om ons heen bestaat uit atomen, is misschien wel het meest vruchtbare idee van de natuurwetenschap. Als alle materie bestaat uit identieke deeltjes in maar een paar soorten - die elkaar kunnen aantrekken of afstoten, en soms aan elkaar blijven plakken - zijn in principe alle natuurverschijnselen te begrijpen.
Het getal van Avogadro - door wiskundigen geschreven als 'Na' - vertelt je hoeveel atomen ergens in zitten. 'Na' is enorm groot, omdat atomen erg klein zijn. Als het getal van Avogadro maar duizend was, zouden atomen zo groot zijn als rijstkorrels.
Waar komt het idee van atomen en moleculen vandaan?
De Griekse filosoof Democritos stelt in de vijfde eeuw voor Christus al dat de wereld uit ontelbaar veel piepkleine blokjes moet bestaan. Het idee dat materie uit atomen bestaat is dus al millennia oud. Heel lang blijft het precies dat: een idee. Bewijs is er niet.
Wil je meer lezen over de ontdekking van atomen en moleculen en de manier waarop die zijn gerangschikt in het periodiek systeem? Kijk en lees dan hier verder.
In de 19e eeuw ontdekken scheikundigen iets heel merkwaardigs: als twee gassen A en B met elkaar reageren tot een nieuw gas zonder dat er een restje A of B overblijft, dan is de verhouding tussen volume A en volume B altijd heel simpel en vaststaand, bijvoorbeeld exact 2 : 3 of 1 : 2.
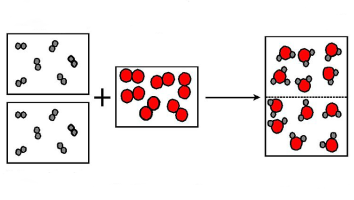
Amedeo Avogadro (1776-1856) stelt in 1811 dat dit komt omdat gassen uit atomen bestaan, die bij een chemische reactie vaste combinaties aangaan. In het voorbeeld hierboven combineren altijd 2 atomen A en 3 atomen B met elkaar. Maar dan nog klopt die simpele volume-verhouding 2 : 3 alleen, als in gas A en in gas B precies evenveel atomen per liter zitten. Zo komt Avogadro tot de naar hem genoemde wet: Bij gelijke druk en temperatuur bevat 1 liter gas altijd exact hetzelfde aantal atomen.

Avogadro zelf heeft geen idee hoeveel atomen/moleculen er in een liter gas zitten, behalve dat het er heel veel moeten zijn. De officiële definitie van Na, het getal van Avogadro, is niet gebaseerd op het aantal deeltjes in een liter gas, maar hangt daar wel nauw mee samen (zie de volgende paragraaf). Tegenwoordig weten we dit getal vrij nauwkeurig:
Na = 6,02214076 x 10^23 , waarbij de laatste decimaal onzeker is.
Wat kun je je voorstellen bij zo'n gigantisch getal? Van alles. Het is ongeveer het aantal vingerhoedjes zeewater in de oceaan. Het is, gemiddeld, het aantal keren dat je moet gooien, voordat je met dertig dobbelstenen tegelijk alleen maar zessen gooit. Als je 'Na' bytes geheugen wilt voor al je muziek en films, moet je heel Flevoland vol leggen met microSD-kaartjes van 128 gigabyte.
'Na' is op Mars of in een ver sterrenselsel precies hetzelfde als op aarde. Het is een universele natuurconstante, net zoals de lichtsnelheid of de lading van het elektron.

Waarom is de hemel blauw?
Het getal van Avogadro duikt overal in de scheikunde en natuurkunde op. De grootte ervan is zelfs af te leiden uit het feit dat een wolkenloze hemel blauw is. Een flink deel van het blauwe zonlicht bereikt niet in een rechte lijn het aardoppervlak, maar via grillige omwegen, omdat het eerst talloze keren weerkaatst aan moleculen in de lucht.
Vooral het blauwe licht, met een relatief korte golflengte, wordt 'verstrooid' en bereikt ons dus van alle kanten tegelijk, waardoor we een blauwe hemel zien. Het overige zonlicht, met langere golflengtes, wordt veel minder verstrooid, zodat dit wel rechtstreeks vanaf de zon ons oog bereikt. Vandaar dat we de kleur van de zon zelf als geel ervaren.
Verschillende kleuren licht worden door de dampkring op verschillende manieren verstrooid: daarom zien we een blauwe lucht.
In de formule die het verband geeft tussen de golflengte van het licht en de mate van verstrooïing, komt het getal van Avogadro ook voor. Mits je de golflengte van blauw licht weet, geeft de kleur van de hemel zodoende een ruwe schatting voor het getal.
Hoe maak ik zelf een schatting van het getal van Avogadro?
Een bekend experiment in schoollabs is, om een klein druppeltje olie te laten uitvloeien over een wateroppervlak. Als de olievlek niet groter meer wordt, is de vlek nog maar één molecuul dik. Delen van het volume van het druppeltje door de oppervlakte van de vlek geeft je dan de afmetingen van één molecuul olie, dus ook het volume (aannemend dat het molecuul ongeveer bolvormig is). Als je weet welke soort moleculen in je olie zitten, kun je, net als bij lucht, het gewicht bepalen van Na oliemoleculen, en dat kun je weer makkelijk omrekenen naar een volume aan olie. Als je die twee volumes op elkaar deelt, komt daar ongeveer het getal van Avogadro uit.

Serieuze bepalingen van het getal van Avogadro vereisen bijzondere, high-tech methodes. In 2015 is in twee bollen silicium met atoommassa 28, ('de rondste objecten ter wereld') uiterst nauwkeurig het aantal atomen geteld. Dat kon, omdat de silicium-28 atomen in een bijna perfect regelmatige stapeling in zo'n bol zitten. Met röntgenstraling kun je de afstand tussen twee atomen in die stapeling uiterst nauwkeurig meten, dus ook het volume dat één atoom inneemt. Verder is de diameter van de bol, dus ook het volume, zeer nauwkeurig meetbaar. De verhouding van die twee getallen is het aantal atomen in de bol. Men schat de foutmarge van deze telling op 20 atomen per miljard. Elke bol weegt 1000 gram, en moet dus 1000/28 keer Na atomen bevatten. Dus als je alle atomen in de bol telt, legt dit het getal van Avogadro vast.
Waarom is vanaf 2019 het getal van Avogadro exact 602.214.076.000.000.000.000.000?
Hoewel er twintig jaar werk is gestopt in het maken van de silicium-bollen en het zo nauwkeurig mogelijk tellen van die atomen, gebeurt er in 2019 iets vreemds: de CGPM (Conférence Générale des Poids et Mesures ) stelt per decreet vast dat het getal van Avogadro exact 602.214.076.000.000.000.000.000 is, ongeacht wat er uit nog nauwkeuriger tellingen komt! Hoe kan dat? Het aantal atomen in zo'n silicium-bol ligt toch vast? En het zou wel bijzonder toevallig zijn, als het werkelijke aantal inderdaad eindigt op 15 nullen.
Het probleem wat de CGPM hiermee op wil lossen, is dat de grootte van de gram ook niet super nauwkeurig vastgelegd is. De kilogram is nu nog per definitie de massa van een platina cilindertje dat in een kluis in Parijs bewaard wordt. Maar dat brokje platina, de Grand K, dateert uit 1875, en niemand weet hoe z'n massa sindsdien veranderd is. Wel is gemeten, dat als je hem vergelijkt met diverse replica's die ook al lang geleden gemaakt zijn, er verschillen van zo'n 50 microgram – 50 per miljard - opgetreden zijn.
Het bepalen van een kilo aan de hand van le grand k is "een stomme situatie waar we snel vanaf moeten". Op welke manier moeten we de kilo dan meten?
De grap is: als je niet heel precies weet hoeveel een gram is, kun je ook niet heel precies tellen hoeveel atomen silicium-28 samen 28 gram wegen. Door het getal van Avogadro per decreet vast te leggen op het bovenstaande getal, leg je ook de grootte van de gram (dus ook de kilogram) vast. Stel, dat latere tellingen van het aantal atomen in de bol uitkomen op een getal dat 0,0000001 procent hoger is dan de huidige waarde. Dan betekent dit, dat de kilogram bij nader inzien 0,0000001 procent zwaarder is dan we nu denken.
Omdat de foutmarge in het getal van Avogadro - 20 per miljard - kleiner is dan 50 per miljard, kun je beter de kilogram definiëren met behulp van 'Na' dan andersom. Een vergelijkbare truc heeft het CGPM al eerder uitgehaald met een andere natuurconstante, namelijk de lichtsnelheid. Die is in 1983 vastgesteld op 299.792.458 meter per seconde, en geen millimeter meer of minder. Sindsdien heeft het nog wel zin om uiterst nauwkeurige metingen te doen aan hoe snel licht zich voortplant, maar daarmee meet je eigenlijk niet de lichtsnelheid, maar de lengte van de meter! De definitie van de meter is namelijk: de afstand die licht in 1/299.792.458 seconde aflegt (de seconde wordt onafhankelijk gedefinieerd).
Op deze manier kunnen meterologen (dat is een echte specialisatie binnen de natuurkunde) het geheel aan natuurconstantes verankeren aan de natuurconstantes die met de kleinste foutmarge gemeten zijn.
De grand k in Parijs is niet langer de standaard. Vanaf 20 mei 2019 wordt een kilo bepaald aan de hand van een wiskundige formule gebaseerd op de constante van Planck.
Met behulp van het getal van Avogadro kun je zelfs vrij eenvoudig uitrekenen hoeveel moleculen je telkens in- en uitademt. Als je weet dat een ademteug uit ongeveer een halve liter lucht bestaat, zitten daar op zeeniveau ongeveer 1,2 x 10^22 moleculen in. Ongemerkt blaas je dus tijdens het lezen van dit artikel bij elke ademhaling 120.000.000.000.000.000.000.000 moleculen uit!
In het kort
Het getal van Avogadro vertelt je hoeveel atomen er in 'een handjevol spul' zitten. Dit getal is enorm groot, namelijk 6,02214076 x 10^23.
Met het getal van Avogadro kan je bijvoorbeeld uitrekenen hoeveel atomen je in en uit ademt. Het getal is namelijk gebaseerd op de massa van atomen, en die druk je uit in grammen.
Blauw licht wordt meer verstrooid dan andere kleuren licht, daarom zien we een blauwe lucht. Op basis van de golflengte van blauw licht kan je een schatting maken van het getal van Avogadro.
Door simpelweg een druppeltje olie op een wateroppervlak te laten vallen kan je, na een rekensom, het getal van Avogadro benaderen. Serieuze bepalingen van dit getal vereisen bijzondere high-tech methodes.
Omdat de grootte van een kilo niet heel precies is vastgelegd, kan het getal van Avogadro ook niet precies worden berekend. Daarom is het getal nu precies vastgesteld, ongeacht wat er uit nog nauwkeuriger tellingen komt.
En je weet het!
Anderen het laten weten?
